The Total Synthesis Of Reserpine
Reserpine merupakan obat yang disebut rauwolfia
alkaloid. Reserpine mengurangi jumlah zat kimia tertentu dalam otak (misalnya norepinephrine dan serotonin),
yang mana membantu merendahkan tekanan darah dan mengurangi peradangan pada
pasien yang memiliki masalah mental tertentu.
Struktur dari reserpine (I: R = MeO, R '= Me, R "= 3,4,5- (MeO),
C, H, COO). Jadi, sudah jelas sejak awal bahwa reserpin adalah anggota dari R
". Kelompok alkaloid besar dimana (I: R = R '= R "= I-l) adalah
prototipe.
Mekanisme Reaksi pada reserpine
Sebuah sintesis katalitik, enantioselektif (+) -
reserpin dilaporkan. Reaksi ini aza-Diels-Alder yang dikontrol dengan katalis,
di antara 6-methoxytryptamine-derived dihydro-β-carboline dan enone diperkaya
α-disubstitusi enone untuk membentuk kunci tetracyclic intermediate. Elaboras (+)
- reserpin mencakup siklisasi aldol intramolekuler dan hidrogenasi yang sangat
diastereoselektif dari enoate yang terhambat secara sterik. Reserpin (1) telah
mewakili target ikonik untuk sintesis organik sejak diisolasi enam dekade yang
lalu. Struktur pentasiklik kompleks stereokimia dari alkaloid indole ini terus
berfungsi sebagai forum untuk mengeksplorasi batas sintesis stereoselektif, 2 terlepas
dari mekanisme ini, masing-masing pendekatan yang berhasil terhadap molekul ini
bergantung pada strategi fundamental yang sama, yaitu generasi tahap akhir dari
cincin-C dan stereotenter C3 yang disematkan. Dari 2,3-seco-derivatif (2, Skema
1) .3 Pendekatan ini umumnya diperumit oleh pembentukan preferensial pusat C3
dengan stereokimia relatif yang tidak diinginkan termodinamika yang diinginkan,
4 Keterbatasan ini diatasi dengan cara yang sangat terkenal dan elegan. Dalam
sintesis Stork, dimana konfigurasi C3 yang diinginkan dipasang melalui siklisasi
yang dikontrol secara kinetis dari amino-nitril 2,3-seco-derivatif.
Analisis retrosintetik (+) - reserpin
Upaya sintetis terhadap komponen enone yang
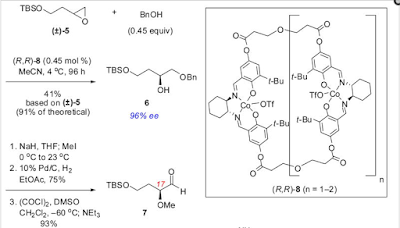
diperlukan 4 dimulai dengan resolusi kinetik alkohol selektif dari terminal
epoksida rasemat. Trioksida triol 6 yang dilindungi secara protektif diperoleh
pada 96% ee melalui penggunaan katalis salen kobalt oligomer 8,9 yang
menggunakan benzil Alkohol sebagai nukleofil (Skema 3). Prosedur ini terbukti
lebih efisien dan dapat diandalkan di tangan kita daripada rute yang berasal
dari asam malat, 10 terutama bila diterapkan pada skala multi gram. Elaborasi
alkohol yang dilindungi 6 sampai aldehida 7 dilakukan dalam urutan 3 langkah
yang terdiri dari metilasi alkohol sekunder, hidrogenolisis selanjutnya dari
benzil eter, dan oksidasi Swern dari alkohol primer yang dihasilkan. Kelompok
α-metoksi aldehida 7 kemudian berfungsi untuk mengarahkan atilasi
alergenomerektif terkontrol khelasi, dengan demikian memasang pusat stereogenik
C18 yang berdekatan dan memberikan vinil bromida 9 sebagai satu diastereomer
tunggal.11 Akhirnya, elaborasi untuk enone 4 dilakukan melalui perlindungan C18
Alkohol, diikuti oleh pertukaran lithium-halogen dan penambahan selanjutnya ke
N-methoxy-N-methylacetamide.
Sintesis stereokelektif enone 4
Kombinasi kunci enid 4 dan
6-methoxytryptamine-derived dihydro-β-carboline 37 untuk menghasilkan teton
ketracyclic 11 kemudian diperiksa berdasarkan serangkaian kondisi (Skema 4).
Reaksi FADA dapat dilakukan dengan sedikit kelebihan enone 4 (1,2 ekivalen)
relatif terhadap imina 3 hanya dengan katalis amina primer, sesuai dengan
pengamatan sebelumnya yang menggunakan turunan enone sederhana dan terhambat.12
Tingkat diastereokontrol yang diinduksi substrat intrinsik dievaluasi
Menggunakan promotor amina amina. Dengan stoikiometri n-heksilamina, 13 keton
11 dan 12, yang mengandung hubungan trans antara stereitis yang baru terbentuk
C3 dan C20, dihasilkan dalam rasio 1asterh 1aster (dr) (entri 1). Sebaliknya,
kadar diastereosektifitas kiral yang dikendalikan tinggi diamati dengan adanya
20 mol% aminothiourea 10,7 yang memberikan diasteromeromer yang diinginkan 11
dalam hasil terisolasi 76%. Khususnya, eninomer primer aminothiourea ent-10
menginduksi pembalikan diastereoselektivitas dalam reaksi FADA untuk
meningkatkan keton 12 secara selektif.
Diastereoselektif tiourea-dikatalisis formal
aza-Diels-Alder reaksi
Penutupan cincin E untuk melengkapi kerangka
karbon reserpin dilakukan dengan reaksi aldol intramolekuler keto-aldehida 15
(Skema 5). Intermediate 15 diperoleh dalam dua langkah dari aduk FADA 11
melalui pembelahan dari eter TBS primer dengan HF piridin-buffer dan oksidasi
alkohol primer yang dihasilkan dengan periode Dess-Martin. Perlakuan aldehid
mentah 15 dengan piperidin dan katalis TsOH menghasilkan reaksi aldol enamine
intramolekul untuk menghasilkan alkohol tersier C15 16 sebagai satu
diastereomer tunggal. Oksidasi pinnick aldehida 16 ke asam karboksilat yang
sesuai diikuti dengan esterifikasi dengan diazometana yang diberikan metil
ester 17.
Penyelesaian sintesis (+) - reserpin
Setelah secara efisien mengakses kerangka
pentacyclic reserpin melalui reaksi FADA yang dikatalisis oleh thiourea dan
siklisasi aldol berikutnya, tantangan utama yang tersisa melibatkan pengurangan
alkohol C15 yang terhambat dari 17 dengan pengenalan fusi-fusi yang diinginkan
pada D dan E Persimpangan. Sementara upaya untuk mendapatkan produk pengurangan
yang diinginkan secara langsung melalui deoksigenasi radikal tidak berhasil,
strategi eliminasi / pengurangan terbukti berhasil. Penghilangan secara
esensial terhadap α, β-ester tak jenuh 18 diinduksi melalui trifluoroasetilasi
alkohol 17 dan eliminasi berikutnya dengan DBU. Setelah melakukan evaluasi
ekstensif terhadap sistem katalitik homogen dan heterogen di bawah kisaran
kondisi, kompleks iridium kationik 20,14 yang memiliki penghambat BArF yang
tidak berkoordinasi, diidentifikasi efektif secara unik dalam reduksi enoate
18.15 Sebagai tambahan, hidrogenasi berlanjut dengan tingkat signifikan
Selektivitas wajah (6: 1 dr), pada akhirnya memberikan ester jenuh yang
diinginkan 19 dalam hasil terisolasi 44% (81% berdasarkan olefin yang
dipulihkan 18). Penugasan stereokimia senyawa 19 dikonfirmasi dengan analisis
kristalografi sinar-X.
Dengan pentacycle yang telah diuraikan secara
lengkap, sintesis selesai hanya membutuhkan deproteksi global dan pemasangan
ester trimetoksibenzoyl pada cincin E. Dengan demikian, perlakuan 19 secara
berurutan dengan amalgam TfOH dan natrium-merkuri menghasilkan pembelahan
kelompok eter PMB eter dan tosil. Alkohol sekunder C18 yang dihasilkan
diesterifikasi menggunakan kondisi yang dilaporkan sebelumnya untuk
menghasilkan reserpin ((+) - 1) .3i
Sintesis reserpin enantioselektif reserpin
dilakukan pada 19 langkah dalam urutan linier terpanjang dari rasemat epoksida
5. Pendekatan konvergen bergantung pada katalis kiral untuk memberikan akses ke
komponen penggandengan 4 dan untuk mengatasi pemasangan stereogenik C3 yang
bermasalah secara historis. Penerapan lebih lanjut dari reaksi aza-Diels-Alder
aminothiourea-katalis dalam sintesis alkaloid kompleks dari asal alami dan
sintetis diantisipasi.
Sumber:
Woodward. R.B, et all., The total synthesis of
reserpine.1956.Hrvard University.










Apa yg menjadi keunikan dari sintesis resepine ini? Dan bagaimana menurut saudara mengenai kegunaan dari senyawa ini jika di pasaran dikemas dalam bentuk yang bagaimana?
BalasHapusapakah prinsip dari reaksi Diels-Alder pada sintesis reserpin ini?
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapusApa kelebihan dan kekurangan dari sintesis reserpine?
BalasHapusApa perbedaan reserpine (+) dan (-)?
BalasHapusdidapatkan pada tumbuhan apakah reserpine tersebut dan termasuk golongan senyawa apa?
BalasHapusReserpin itu dapat disintesis dengan senyawa apa saja ya?
BalasHapusPada sintesis reserpin ini, apakah ada penggunaan gugus pelindung ?
BalasHapus